Multiple lines of evidence for disruption of nuclear lamina and nucleoporins in FUS amyotrophic lateral sclerosis
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)の新規モデルマウスをゲノム編集技術CRISPR-Cas9システムを用いて作成することに成功しました。このモデルマウスには、本邦の家族性ALSにおいてSOD1遺伝子の異常に次いで多いFUS(fused-in sarcoma)遺伝子の異常(FUS-H517D)に相当する点変異を導入しました。今回作成したマウスは、従来のトランスジェニックマウスとは異なり、ゲノム編集技術を用いて内在性のFUS遺伝子の遺伝子変異を加えることで、より生理的な条件で、患者に近い疾患モデルとして病態解析や治療薬開発への応用が可能です。このモデルマウスは、加齢とともに歩行などの運動機能障害を示し、脊髄運動ニューロンの減少に加え核膜および核膜孔の障害、DNA障害を認めました。さらに、我々が確立した同一の変異(FUS-H517D)を持つALS患者由来のiPS細胞から分化誘導した運動ニューロンでも核膜および核膜孔の障害を明らかにし、RNA-seq解析ではFUS-H517D変異を持つ運動ニューロンにおいて、核膜および核膜孔関連する遺伝子の多くが有意に発現低下していることが示されました。さらに、ALS患者の死後組織でも脊髄運動ニューロン神経の核膜および核膜孔の障害が示されました。
神経細胞において本質的である核膜の障害は、細胞の生存維持に決定的な要因となります。この核膜障害の改善なくしては、ALSの治癒は望めません。この研究成果は、ALSで見られる遺伝子異常を再現したゲノム編集マウスが、加齢に伴い運動機能障害を示し、脊髄運動ニューロンにおける核膜および核膜孔の障害がALSの決定的な病態メカニズムであり、新規治療ターゲットであることが示されました。ゲノム編集マウス・iPS細胞と患者病理検体といった研究材料を組み合わせることで、ALSの病態理解を深め、治療薬開発が飛躍的に推進されます。
以上の事柄について、『Brain』誌に報告しました(貢献内容:ヒト疾患iPS細胞モデルおよびマウスモデルを用いたALS関連IDP異常に伴う核膜およびDNA障害の同定)。

Keywords: FUS; amyotrophic lateral sclerosis; nuclear lamina; nuclear pore complex
Author: Kensuke Okada, Daisuke Ito†, Satoru Morimoto, Chris Kato, Yuki Oguma, Hitoshi Warita, Naoki Suzuki, Masashi Aoki, Junko Kuramoto, Reona Kobayashi, Munehisa Shinozaki, Masahito Ikawa, Jin Nakahara, Shinichi Takahashi, Yoshinori Nishimoto, Shinsuke Shibata and Hideyuki Okano†.
†co-correspondence
Journal: Brain. 2024 Sep 23:awae224. doi: 10.1093/brain/awae224.
投稿者プロフィール

- Project Associate Professor
-
Satoru Morimoto, M.D., Ph.D.
Keio University Regenerative Medicine Research Center (KRM)
Project associate professorResearch Gate Building TONOMACHI 2, 4B, 3-25-10, Tonomachi, Kawasaki-ku, Kawasaki-shi, Kanagawa,
210-0821, Japan
最新の投稿
 ノンドメインブログ2026.02.16第八節 あらゆる可能性に向けた 再生医療へのどとう怒濤の挑戦
ノンドメインブログ2026.02.16第八節 あらゆる可能性に向けた 再生医療へのどとう怒濤の挑戦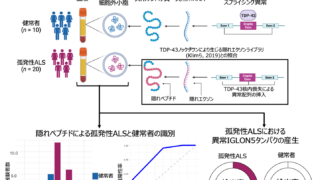 令和7年度(FY2025)2026.01.29Diagnostic potential of cryptic exon-derived peptides in serum extracellular vesicles for sporadic amyotrophic lateral sclerosis
令和7年度(FY2025)2026.01.29Diagnostic potential of cryptic exon-derived peptides in serum extracellular vesicles for sporadic amyotrophic lateral sclerosis ノンドメインブログ2026.01.01第七節 臨床に応用できて価値がある 再生医療への本格的挑戦
ノンドメインブログ2026.01.01第七節 臨床に応用できて価値がある 再生医療への本格的挑戦 令和7年度(FY2025)2025.12.05A genome-wide association study identifies the GPM6A locus associated with age at onset in ALS
令和7年度(FY2025)2025.12.05A genome-wide association study identifies the GPM6A locus associated with age at onset in ALS


