Swift induction of human spinal lower motor neurons and robust ALS cell screening via single-cell imaging
ALSは進行性の致死性神経変性疾患です。運動ニューロンの変性・脱落にともない、筋力低下、呼吸不全をきたし、最終的に3-5年の経過で死に至ります。しかし、ALSの病態メカニズム、特に神経変性のメカニズムの全容は未だ明らかではなく、治療法の確立には時間を要しています。このため、ALSの疾患理解を深め、候補薬の治療効果を迅速に評価できる技術への高いニーズがあります。 近年、iPS 細胞を用いた研究は ALS の疾患理解や薬剤スクリーニングにおいて大きな可能性を示しています。しかし、これまでの疾患研究、薬剤スクリーニングの多くは、主に、家族性ALS(注4)に特徴的な特定の遺伝的異常を持つ細胞を用いた研究に限られており、ALS 患者の 9 割を占め、疾患の多様性に富む孤発性ALS(注5)へのアプローチはあまりされていないという問題がありました。
これは、従来の手法では運動ニューロンの誘導効率が低く、誘導と表現型評価に多大な時間と労力を要するために、多様な背景を持つ孤発性ALS を対象とした大規模な実験が困難であったことに起因します。そこで、共同研究グループは、iPS細胞から脊髄型の下位運動ニューロンを迅速かつ高効率で誘導する方法を開発し、さらにAI画像解析技術を用いた疾患表現型の簡便かつ再現性の高い評価法を開発しました(図1)。
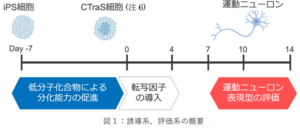
本研究のポイントは、
1)新しい高効率な下位運動ニューロン誘導法: ヒト iPS 細胞から下位運動ニューロンを高効率(約80%)で誘導する新しいプロトコルを開発しました。従来法と比較して短期間で効率的に分化を達成し、ALS 病態の解明や薬剤スクリーニングへの応用が期待されます。
2)ALS 病態の再現: 遺伝性 ALS 患者由来の iPS 細胞から誘導した下位運動ニューロンにおいて、 ALS 特有の病態(TDP-43 および FUS タンパクの異常な凝集)を再現しました。このことから、本研究の手法が ALS 研究に適したモデルであることが示されました。
3)機能的な神経活動の確認: 誘導した下位運動ニューロンで成熟したニューロンと同様の発火活動やネットワーク活動を MEA(マルチ電極アレイ)システムを用いて確認することができました。
4)ALS 細胞の脆弱性評価: 経時的なライブイメージングとシングルセル追跡技術、および AI 画像解析技術を活用し ALS 患者由来下位運動ニューロンが健康な細胞に比べて生存率が低い傾向にあることが示されました。この傾向は撮像に基づいた従来の単純な細胞体カウントでは明確には示すことができませんでした。この技術は、ALS 患者由来細胞ごとの細胞脆弱性を評価するための有望なツールです。
この下位運動ニューロン誘導法は、ALS 患者由来の iPS 細胞を用いた迅速かつ効率的な薬剤スクリーニングのための基盤となります。これにより、ALS 特有の症状の早期発見や、患者ごとの異なる病態に対応した個別化医療の実現に向けた研究が進むと考えられます。また、病態の異なる ALS 患者由来の iPS 細胞株を用いた大規模な研究や、シングルセル追跡技術とオミクス解析を組み合わせた単一細胞レベルでの詳細な研究に応用されることで、複雑な病態をもつ ALS の疾患理解が進むことが期待されます。さらに、本手法は、他の神経変性疾患のモデル構築や創薬研究にも応用可能であり、神経疾患全般の治療法開発への貢献が期待できます。
以上の事柄について、『Stem Cell Reports』誌に報告しました(貢献内容:ヒトにおけるIDP作用同定のための神経モデル・評価法の開発)。
Keywords: ALS; disease modeling; iPSC; image analysis; machine learning; motor neuron; single-cell analysis.
Author: Setsu S, Morimoto S†, Nakamura S, Ozawa F, Utami KH, Nishiyama A, Suzuki N, Aoki M, Takeshita Y, Tomari Y, Okano H†.
†co-correspondence
Journal: Stem Cell Reports. 2024 Dec 10:102377. doi: 10.1016/j.stemcr.2024.11.007.
投稿者プロフィール

- Project Associate Professor
-
Satoru Morimoto, M.D., Ph.D.
Keio University Regenerative Medicine Research Center (KRM)
Project associate professorResearch Gate Building TONOMACHI 2, 4B, 3-25-10, Tonomachi, Kawasaki-ku, Kawasaki-shi, Kanagawa,
210-0821, Japan
最新の投稿
 ノンドメインブログ2026.02.16第八節 あらゆる可能性に向けた 再生医療へのどとう怒濤の挑戦
ノンドメインブログ2026.02.16第八節 あらゆる可能性に向けた 再生医療へのどとう怒濤の挑戦 令和7年度(FY2025)2026.01.29Diagnostic potential of cryptic exon-derived peptides in serum extracellular vesicles for sporadic amyotrophic lateral sclerosis
令和7年度(FY2025)2026.01.29Diagnostic potential of cryptic exon-derived peptides in serum extracellular vesicles for sporadic amyotrophic lateral sclerosis ノンドメインブログ2026.01.01第七節 臨床に応用できて価値がある 再生医療への本格的挑戦
ノンドメインブログ2026.01.01第七節 臨床に応用できて価値がある 再生医療への本格的挑戦 令和7年度(FY2025)2025.12.05A genome-wide association study identifies the GPM6A locus associated with age at onset in ALS
令和7年度(FY2025)2025.12.05A genome-wide association study identifies the GPM6A locus associated with age at onset in ALS


