組み換えタンパク質発現・精製TIPS
今回、お題が「私のちょっとした実験ハック」ということで、私に何が語れるかを考えると、やはり組み換えタンパク質の発現・精製に関することかな、という結論になりました。生体物質の立体構造解析には組み換えタンパク質の大量発現・精製は必須です。組み換えタンパク質の精製を試みたもののうまくいかなかった、という経験がある人は多いと思います。今日は私のこれまでの経験から、いくつかの役に立ちそうなTIPSをお話ししたいと思います。「そんなこと知っているよ」ということが大半かとは思いますが、お付き合いください。
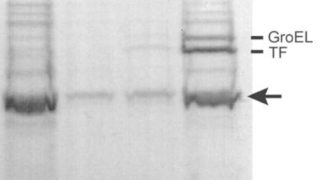
まず、大腸菌で目的タンパク質を発現させて、発現していたもののほとんどが沈殿してしまって可溶化しなかった、という経験を持つ方は多いのではないでしょうか。この場合、可溶性画分に少しバンドが見える場合は、pHやイオン強度の変化、非変性界面活性剤の添加で可溶性が向上することはあるかもしれません。また、大腸菌の培養温度を18度まで下げたり、シャペロンタンパク質を共発現したりすることで可溶性画分が増えることも多いです。図の写真はシャペロンタンパク質を共発現させることで可溶性画分が劇的に上昇した例です。ここではGroEL・ESとTF2を共発現させています。このころはまだ売られていなかったのですが、今はタカラバイオからプラスミドが売られているので、実際に使ったことがある人も多いと思います。ただし、私のこれまでの経験上、可溶性画分にほとんどバンドが見えない場合には、上述の手法はうまく働かない場合が多いです。コンストラクトの変更や結合するタンパク質との共発現や共精製を検討したほうが良いでしょう。
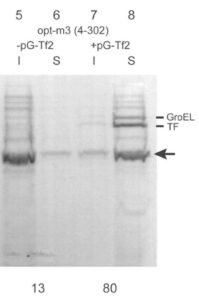
ヒト由来eIF2αサブユニットの可溶化。シャペロンプラスミドを加えたときに大幅に可溶化画分にくるタンパク質が増えた(Ito and Wagner (2004) J Biomol NMR)
融合タンパク質にすると可溶性が上がることは多々あります。融合させるタンパク質としていくつかの選択肢がありますが、とても一般的ですがやはりGSTとMBPを試すのが良いでしょう。融合タンパク質が可溶化しても、切断すると目的タンパク質部分が不溶性画分に行ってしまうことが多いです。そういう場合には無理に切断しようとせず、融合タンパク質のまま実験を進める系を考える方が得策です。
不溶性画分に行ってしまうタンパク質を融合タンパク質として可溶化させた場合に多いのですが、一見可溶化していても、実際には凝集しているということがあります。タンパク質の精製の最後にゲルろ過カラムにかけることは、それを確かめる上で有効です。最近、Mass Photometry法により一分子レベルで分子量を測定する装置が出てきました(Refeyn社)。これを使える環境にあれば、ある程度の分量や濃度が必要なゲルろ過カラムを用いなくても凝集状態を確認できるので便利かもしれません。
真核生物のタンパク質を組み換え体として大量精製したい場合には、大腸菌よりも昆虫細胞や哺乳細胞を使った方が良い結果が得られる場合が多いです。大腸菌で大量発現できて、精製できた場合でも、哺乳細胞から取ったものと比較すると活性がとても低い、ということも経験しました。ヒト由来培養細胞を使う系では、私のラボではプラスミドpEBMultiと培養細胞Expi293という組み合わせがデフォルトになっています。詳しい話を聞きたい方はご連絡ください。
投稿者プロフィール