液滴撮影法
がん研究所の野澤です。
タンパク質や核酸の液-液相分離現象の観察は随分進んできましたが、相分離液滴を研究対象の1つとされている研究者の方は、どのように液滴を観察されているでしょうか。
カバースリップに張り付いた培養細胞しか観察してこなかった私は、恥ずかしながら、溶液の中の液滴を前にして、さて、どうやってこれを写真に収めたらよいものかと、と考え込んでしまいました。
問題点は3点ありました。
- 使用するサンプル量を節約したい
数日かけて精製・濃縮して得られるタンパク質の容量は、せいぜい数十〜数百µLです。バッファー条件をいくつも変えながら液滴形成を検討するには、一度に用いるサンプル量を10 µL程度に抑えたいところです。
- サンプルが乾いてしまう
96 well plateの隅っこやスライドガラスに、液滴形成を誘導した溶液をほんの少量滴下して観察してみました。しかし、徐々に溶液の端から蒸発していくのが見えて、設定したバッファー条件が保たれているか不安になり、この方法は断念。
- 溶液の厚み(高さ)
液滴を初めて観察すると、おお、これか!と感動するのですが、観察に慣れてきて冷静になってくると、液滴が容器(?)の底に緩やかに沈んでいくことに気がつきます。これではなかなかシャッターチャンスが訪れません。液滴が沈みきるのを待っていると、今度は液滴形成が進行してしまい、他の条件との比較が難しくなります。
これらの問題点を解消できるようなアイテムはないものか、と研究室の中をぐるぐる歩き回って見つけたものがこちらです。
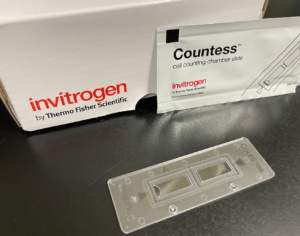
セルカウンター用のチャンバースライド(Invitrogen: Countess™ Cell Counting Chamber Slides)。
このチャンバースライドは、10 µLの容量で、空気に触れる面も少なく、また厚みもありません。上記3点をすべて解決してくれました。さらに良い事には、このチャンバースライドはカバースリップの大きさと大差ないので、蛍光顕微鏡のステージにも乗ります。

込み入った実験になるとやはり96 wellや384 wellで、ということになってしまいますが、簡易的なチェックや条件検討にはもってこいだと思いますので、是非お試しください。
蛇足ですが、ヘテロクロマチン分子のHP1の液滴を観察した初期の論文のSuppl.に“Time-lapse video was taken over approximately 12 minutes using the Hyperlapse application on an iPhone6.” と記述がありました。当時、留学先のラボでこのことが話題にのぼり、ボスのグラントでiPhoneを買ってもらえるんじゃない!?と、冗談を言い合ったことを思い出します。著者の方も液滴を写真/動画に収めるために独自の工夫をなさっていたことが伺えます。
もし、みなさんも独自の液滴撮影法がありましたら教えていただけると嬉しいです。