細胞内での液-液相分離の確認手法
自然科学研究機構生命創成探究センター/基礎生物学研究所の椎名です。近年、細胞内で液-液相分離によってさまざまなコンデンセートが形成されていることが報告されています。これらの現象が実際に液-液相分離であることを確認するために、広く利用されているのが光褪色後蛍光回復法(fluorescence recovery after photobleaching, FRAP)です。しかし、FRAPによる蛍光回復が観察されても、それが液-液相分離であることの確認には不十分との指摘もあります。なぜなら、その構造が液滴ではなくても、速い結合解離により素早い蛍光回復を示すタンパク質も存在するからです。
したがって、形成された構造が液相であることを明確に示すためには、液滴に特有の特性を示す必要があります。一般的に使用される手法の一つは、液滴同士の融合実験です。2つの液滴が融合した後、表面張力によって比較的迅速に球体化するプロセスを観察できます。一方で、固相の構造同士が結合する場合、迅速な球体化は見られないことから、液相と固相を区別することができます。
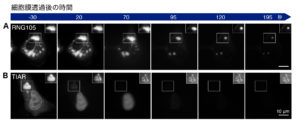
また、別の方法として、我々は細胞膜を透過性にする方法を開発しました(Shiina, JBC, 2019)。液-液相分離は、2つの異なる濃度の溶液が平衡にある状態であり、液滴外の分子濃度を変化させることで、分子が界面を介して出入りし、再び平衡状態に戻ろうとします。この結果、液滴の体積が収縮または膨張するという、風船のような挙動が観察されます。生きた細胞の培養液に界面活性剤を添加して細胞膜を透過性にすると、細胞質の分子濃度が低下し、平衡状態に戻ろうとして液滴が収縮することが観察されます(図A)。
細胞膜を透過性にした場合、固相の複合体からも分子の解離が促進され、その構造は縮小しますが、液滴に比べて非常にゆっくりとした速度で行われます。固相の複合体に含まれるタンパク質の結合解離が速い場合、透過処理後、構造体から素早く消失しますが、構造体自体は素早く収縮することはありません(図B)。
このような細胞膜透過法を使用することで、液相と固相の状態を区別するだけでなく、分子の流動性に関する情報も得ることができます。手軽な手法ですので、ご興味がある方は、ぜひ試してみてください。
投稿者プロフィール