小分子による細胞内相分離の調節
細胞内相分離の重要性がより多くの研究者に認知されるようになったのは、2015年に2報の論文 (PMID: 26317470; 26406374) が発表されてからでしょうか。神経変性疾患のひとつである筋萎縮性側索硬化症 (amyotrophic lateral sclerosis: ALS) では、FUS, TDP-43, hnRNPなど特定のタンパク質が神経細胞の細胞質で凝集体を形成することが知られており、これが神経毒性の原因であると示唆されています。上記論文ではこれらタンパク質凝集が、タンパク質の相分離による液滴形成とそれに引き続く相転移による動態変化で形成されうることが報告されました。細胞内相分離のアイデアの興りである、線虫の生殖顆粒が相分離で形成されることがその6年前に (PMID: 19460965) 、2012年には核小体も液滴のような構造であること (PMID: 21368180) 、相分離が多価相互作用するタンパク質でも誘導されること (PMID: 22398450) が報告され、細胞内相分離の生理現象への関与や生体高分子動態における一般性が徐々に示されてきた背景があったわけですが、この年に、その病態への関与が提示されたことになりました。
2報のうち、FUSの相分離を報告したマックス・プランク研究所 (ドイツ・ドレスデン) のHyman研究室は続いて2017年に、細胞内のエネルギー通貨であるATPが、生理的濃度でタンパク質の相分離を抑制する性質があることを試験管内で示しました (PMID: 28522535) 。生化学反応で必要となるATPがµMの濃度にあるのに対して、その細胞内濃度が数mMである理由は、タンパク質の相分離を抑制するという二次機能のためである、と彼らは提唱しました。本仮説はEMBL (ドイツ・ハイデルベルク) のSavitski研究室が行った、細胞サーマルシフトアッセイ (細胞内タンパク質の熱安定性を観察し、タンパク質のおかれた状況や分子間相互作用を推察する手法) を組み合わせたプロテオーム解析 (thermal proteome profiling: TPP; PMID: 25278616) により補強されました。ATPが濃度依存的に、それを基質としたりタンパク質間相互作用に必要としたりするタンパク質の熱安定性を増加させるだけでなく、相分離する傾向を示すタンパク質の可溶性も増加させることを示しました (PMID: 30858367) 。またごく最近では、神経細胞内でATP量がタンパク質の相分離や凝集に重要であることが示され、本二次機能が生理的に存在することが示唆されました (PMID: 40267187) 。
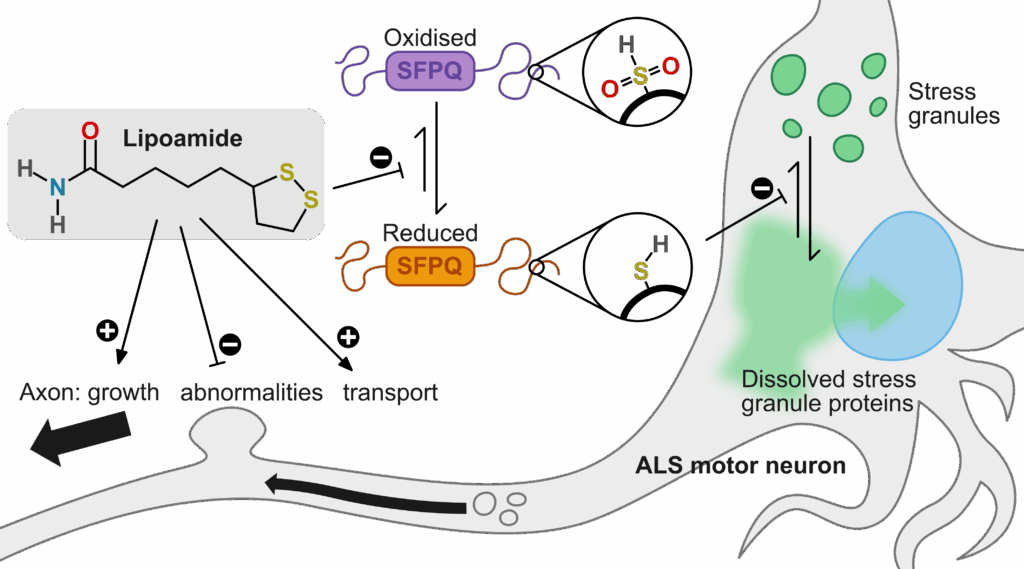
相分離がタンパク質の凝集形成に関与すること、相分離が小分子により調節されること。ここに、相分離が神経変性などの疾患に対する創薬の標的となりうることが示唆されたのでした。で、以後なんやかんやと間が空きまして、今年我々はHyman研究室から、ストレス顆粒 (FUSなどのALS原因タンパク質を構成因子に含み、細胞ストレス下に相分離で細胞質に形成する非膜オルガネラの一つ) の相分離を解消する小分子lipoamideを報告しました (PMID: 40369342) 。すみません、前置きが大変長くなりましたが、最近出ました論文の宣伝です。
ATPの研究により「小分子による細胞内相分離の調節」が提唱された以降、標的タンパク質構造の相分離を抑制するもの、逆に促進するもの、あるいは相分離で生じる構造内の分子流動性を変化させるものなど、幾つかの機能的小分子が報告されてきました (PMID: 33837182; 34234347; 37380771ほか; 各分子の機能は論文を参照ください、また引用漏れがありましたらごめんなさい) 。今回のlipoamideでは、依然完全にではありませんが、これの作用機序にもある程度言及したことになります。
LipoamideはGFP付加FUSで標識された細胞内ストレス顆粒の動態を指標とした化合物スクリーンにより同定され、カルボキサミド基とジチオラン基が炭素鎖で連結された構造を持ちます。細胞にLipoamideを事前処理すると、酸化ストレスによるストレス顆粒の相分離が抑制され、あるいは既にストレス顆粒のある細胞にlipoamideを添加するとこれは消失しました。前述のSavitski研究室と共同で行ったTPPと遺伝学的スクリーンにより、lipoamideは細胞内で特定の標的タンパク質を持つこと、細胞・試験管内解析により、この標的タンパク質の有する「ストレス顆粒タンパク質の相分離を抑制する機能」を、酸化還元状態の調節を介して制御していることが示唆されました。また、前述の通りストレス顆粒の構成因子にはALSの原因因子でもあるFUSやTDP-43などが含まれますが、lipoamide処理はこれら分子による細胞内機能の回復や細胞毒性の緩和にも寄与することがわかりました。
構造活性相関 (structure-activity relationship: SAR) 解析から、ジチオラン基を維持さえしていれば、残りの化学構造の改変によりlipoamideのストレス顆粒抑制活性を上昇させられることがわかりました。また、蛍光標識できるアナログ体の解析からこの分子がストレス顆粒を含む幾つかの細胞内小器官に蓄積する傾向にあること、NMR解析からlipoamideが細胞内にmMの濃度で取り込まれていることが分かり、細胞内濃度が上がるような構造改変 (細胞により取り込まれるないしより内部保持される) が、lipoamideを今後ALSに対する創薬の視点で開発していく場合に重要になるかもしれません。
さて、上記先行研究の多くは外来の小分子に着目したものであり、lipoamideも哺乳類細胞において、(リポイル基として一部のタンパク質に共有結合された形で存在はしますが) 小分子としては外来のものになります。一方で、ATPは内在に生合成される生体分子です。現在私は、このように内在性の分子による細胞内相分離への作用、つまり細胞・組織がタンパク質の熱力学を制御する内在機構・細胞内環境に興味があります。本領域ではタンパク質相分離が細胞機能をどのように制御するのかを、細胞接着分子と組織形態形成をモデルとして解析する研究課題で採択頂いていますが (こちらは期内に研究成果の項で報告できるよう頑張ります) 、逆に細胞が内在相分離をどのように制御しているかにも着目し、双方向性の研究を進めながら、生体分子・細胞が「生物らしい」ダイナミクスを発現する根底にあるものを理解できればと思っています。